October 21, 2025
Leader nell’innovazione tecnologica della chirurgia vertebrale
Tsunami Medical S.r.l con i suoi prodotti impiantabili di ultima generazione è stata il protagonista dell’evento inaugurale dei Medical Devices Virtual Talks di JSB Solutions.
Fondata nel 1997 nel cuore della Biomedical Valley, nei pressi di Modena, ad oggi l’azienda vanta il titolo di leader nell’innovazione tecnologica della chirurgia vertebrale, con un focus principale su soluzioni mediche realizzate utilizzando la tecnologia della stampa 3D in titanio. Una realtà professionale che conta 20 anni di esperienza nel design e nella produzione di dispositivi medici di alta qualità, con una distribuzione di calibro internazionale.
Con il nuovo Regolamento sui Dispositivi Medici (UE 2017/745), tutti i prodotti di Tsunami Medical passeranno dalla classe IIB alla classe III ad eccezione di alcuni, come viti, barre e dispositivi con batteria e motore, che rimarranno in classe IIB.
I prodotti realizzati soddisfano le tendenze attuali dei mercati internazionali offrendo soluzioni chirurgiche spinali ad alto livello qualitativo: dispositivi medici che rispettano e ottemperano ai requisiti normativi e gli standard di qualità internazionali imposti, non solo per fare la differenza nel settore della biomedica ma soprattutto, nella vita delle persone. L’azienda si pone ogni giorno l’obiettivo di studiare e proporre offerte differenziate e sempre più innovative ai clienti al fine di migliorarne la mobilità e la qualità di vita.
Inizialmente l’azienda era coinvolta principalmente nella produzione di dispositivi diagnostici invasivi come subappaltatore di alcune grandi aziende manifatturiere; nel corso degli anni è cresciuta fino all’acquisizione del marchio Bloodline, molto noto nei mercati internazionali della biopsia e della vertebro-plastica spinale.
A partire dal 2010 Tsunami Medical ha iniziato la progettazione e la produzione della tecnologia Selective Laser Melting (SLM), che ha portato poi alla realizzazione del vasto portfolio di prodotti implantabili attualmente disponibile.
La classificazione di un dispositivo medico deve necessariamente avvenire a monte del progetto perché in base alla classe, verranno definiti tutti gli adempimenti, le linee guida e le normative da rispettare.
Le classi dei dispositivi medici sono definite e inquadrate sulla base di 22 regole specifiche, tra cui la loro destinazione, il loro rischio d’uso, la durata di esposizione, l’invasività e l’energia
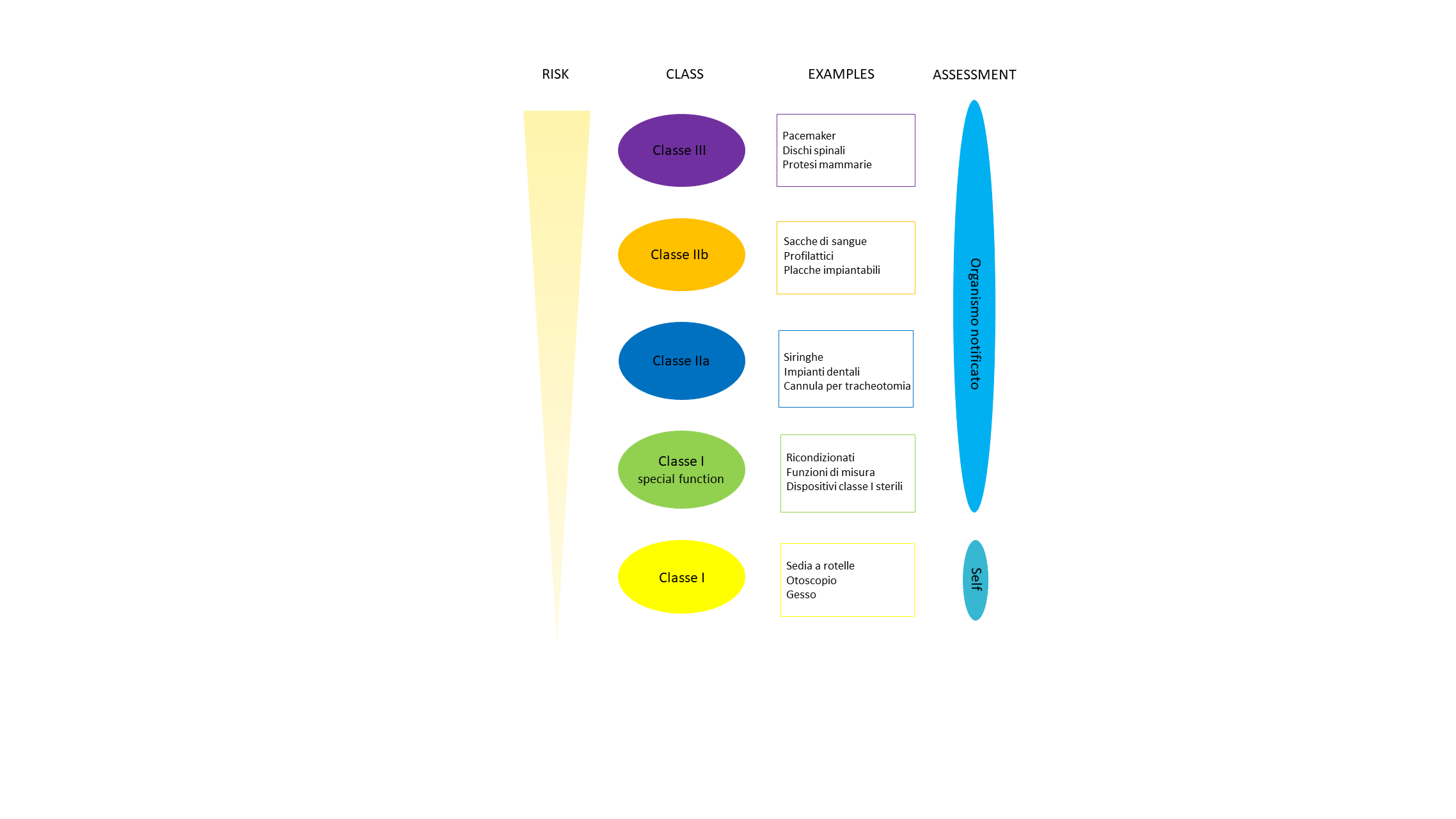
*Le informazioni riportate nel grafico riferiscono a casi generici. Si raccomanda di valutare accuratamente le caratteristiche peculiari del proprio dispositivo prima della classificazione.
Scopri di più
Vai al case study